Etude de la biosynthèse de l’azinomycine B
C. Corre, P.A.S. Lowden
School of Biological and Chemical Sciences, University of Exeter,
Stocker Road, Exeter, Devon EX4 4QD , Royaume-Uni
Introduction:
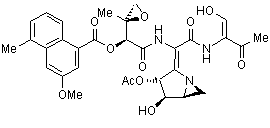
Le métabolite secondaire Azinomycine B (AZB) (1) (Fig. 1), produit par Streptomyces sahachiroi, présente une remarquable activité antitumorale contre différentes lignées cellulaires. L’AZB forme rapidement des liaisons double-brins dans l’ ADN par réaction des cycles époxide et aziridine avec les atomes N-7 des purines (Guanine et Adénine). La compréhension des voies de biosynthèse de ce composé est essentielle pour permettre des études enzymatiques et génétiques plus détaillées.
De nouveaux analogues de cet agent antibiotique et anticancéreux peuvent alors être produits (par modification de précurseurs ou d’étapes de la biosynthèse).
Méthodologie et Résultats:
Les bacteries S. sahachiroi ont été nourries avec des précurseurs primaires (Fig. 2) et avancés (Fig. 3) marqués par 2H ou 13C. Les profils d’incorporation ont ensuite été analysés par spectrométrie de masse (electrospray) et par 1H-, 2H- et 13C-RMN spectroscopie.
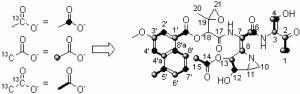 Fig. 2. Profil d’incorporation d’acétates marqués dans l’AZB
Fig. 2. Profil d’incorporation d’acétates marqués dans l’AZB
Ces résultats confirment l’origine polyacétique du fragment naphtoate. Ils sont cohérents avec thréonine agissant en tant que précurseur du fragment cétonique (partie droite) et, de façon inattendue, a-cétoglutarate apparaît être un précurseur dans la biosynthèse du fragment aziridine.
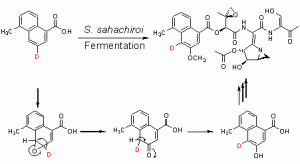 Fig. 3. Mécanisme d’oxydation du fragment naphtoïque de l’AZB
Fig. 3. Mécanisme d’oxydation du fragment naphtoïque de l’AZB
Divers composés naphtoïques deutérés ont aussi été nourris, prouvant l’ordre des transformations biosynthétiques en même temps que le mécanisme d’oxydation du fragment naphtoïque (Fig. 3).
(1) T. J. Hodgkinson, M. Shipman, Tetrahedron 2001, 57, 4467-4488.
L’optimisation instrumentale du protocole analytique GC-MS – à savoir la séparation chromatographique et la gestion des ions de masse en mode SIR – a été élaborée pour l’analyse de traces de T3 et T4 et les limites de détection actuelles sont de l’ordre de 20 pg pour chacune des hormones.
Une mise en œuvre dans des tests in vivo de 13C9-T4 comme traceur métabolique a été réalisée sous contrôle vétérinaire sur le chat et le lapin grâce à la collaboration du Département de Biochimie Clinique de la Royal Infirmary d’Edinburgh. Ils nous ont permis de démontrer la faisabilité de la méthodologie (incorporation de la sonde et son suivi temporel) et la possibilité d’utiliser ces traceurs comme sondes chez l’homme.